Gli ioni sono particelle che presentano una carica elettrica positiva o
negativa. Gli ioni positivi si chiamano anche cationi e si formano quando uno o
più elettroni vengono allontanati dall’atomo. Gli ioni negativi si chiamano
anche anioni e si formano quando uno o più elettroni vengono acquistati
dall’atomo
L’energia necessaria per allontanare gli elettroni da atomi liberi si
chiama energia di ionizzazione Ei. Più precisamente l’energia di
prima ionizzazione Ei’ è l’energia necessaria per allontanare il
primo elettrone, l’energia di seconda ionizzazione è quella necessaria per
allontanare il secondo elettrone Ei’’ e così via.
X
+ Ei’ = X+ + e-
X = generico atomo neutro Ei’ = energia di prima ionizzazione
X+ = ione positivo o catione e- = elettrone allontanato
Lo studio delle energie di prima ionizzazione ha messo in evidenza che queste non dipendono solo dalla quantità di carica positiva del nucleo, ma anche dalla distanza stessa dell’elettrone dal nucleo dell’atomo. E’ nato così il modello a livelli di energia secondo il quale gli elettroni di un atomo si dispongono in livelli di energia che si trovano a diversa distanza dal nucleo.
X+ = ione positivo o catione e- = elettrone allontanato
Lo studio delle energie di prima ionizzazione ha messo in evidenza che queste non dipendono solo dalla quantità di carica positiva del nucleo, ma anche dalla distanza stessa dell’elettrone dal nucleo dell’atomo. E’ nato così il modello a livelli di energia secondo il quale gli elettroni di un atomo si dispongono in livelli di energia che si trovano a diversa distanza dal nucleo.
Ogni livello contiene un numero
massimo di elettroni e il riempimento avviene sempre a partire dal primo
livello che è quello a più bassa energia.
Livello
|
Numero massimo di elettroni
|
1
|
2
|
2
|
8
|
3
|
8
|
4
|
18
|
5
|
18
|
6
|
32
|
Si chiama struttura (o configurazione) elettronica la rappresentazione
della distribuzione degli elettroni di
un atomo sui diversi livelli di energia
Esempio: l’elemento Cl (Z =
17) possiede 17 protoni e quindi 17 elettroni che si
troveranno: 2 sul primo livello, 8 sul secondo, 7 sul terzo. I primi due sono
livelli completi, il terzo no.
Cl = 2,
8, 7
Poiché i livelli completi corrispondono
all’elemento Ne (Z= 10) la struttura elettronica si può scrivere anche così:
Cl = [Ne] 7
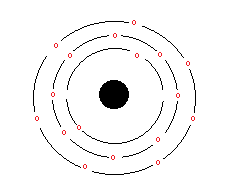 |
| Rappresentazione schematica della distribuzione elettronica nel cloro |
Quando un atomo assorbe una quantità di energia non sufficiente ad allontanare un elettrone, può accadere che questo lasci il livello che occupa normalmente (stato fondamentale) per passare ad un livello di energia maggiore (stato eccitato). Il fenomeno è detto transizione elettronica ed è temporaneo, infatti l’elettrone ritorna allo stato fondamentale restituendo l’energia assorbita sotto forma di radiazione elettromagnetica. Le transizioni elettroniche possono essere osservate attraverso l’esperienza “Le sostanze che colorano la fiamma”.
Nessun commento:
Posta un commento